 19
19
一、主管机构和核心法规
巴西是拉丁美洲较大的医疗器械市场,并且拥有一个完善但是比较复杂的监管体系。 在巴西,医疗器械是由巴西国家卫生监督局(ANVISA)负责监管。 巴西现行医疗器械法规RDC ANVISA 16/2013和欧洲的MDD 93/42/EEC规定较为相似。
二、产品分类
RDC NO. 185附录II阐述了巴西对医疗器械的分类,类似于欧盟的分类规则。根据对人体造成可能风险的高低,由低到高,医疗器械被分为四类,即I类、IIa类、IIb类和III类。体外诊断设备根据产品预期用途风险,也分为四类,即I类、II类、III类和IV类。
三、认证模式
类别 | 质量管理体系审核 | 监管途径 | 对企业要求 |
I类 | I 类和 II 类设备制造商须符合 BGMP 或MDSAP要求。但ANVISA 不会审核。 | 通知 Notificação | l 注册申请表 l 编写符法规要求的技术文档; l 委托持证人(BRH)在巴西注册(需提交技术文档给持证人),注册后即可销售。 |
Ⅱ类 | 注册 Cadastro | ||
III类 | 必须获得巴西生产质量管理规范(BGMP)(或MDSAP可加快认证)证书 | 审核 Registro | l 建立符合EN ISO 13485或MDSAP质量管理体系,并通过BGMP审核,重点为:EN ISO 13485或MDSAP体系审核,必须包括设计开发过程; l INMETRO认证(有源器械); l ANATEL认证(蓝牙、Wi-Fi、射频 (RF) 等通讯功能的设备); l 编写符法规要求的技术文档; l 由ANVISA进行审核,重点为:产品性能研究(各技术指标(具体视各产品而定);生物学评价...等)。 l 部分产品需提交临床研究报告 l 审核通过后,获得合格评定证书; l 委托持证人在巴西注册(需提交技术文档、合格评定证书给持证人)。注册后即可销售。 |
IV类 | 审核 Registro |
打算在巴西销售其医疗器械的外国制造商必须*一名巴西注册持有人 (BRH),负责向 ANVISA 提交必要文件以进行注册程序的当地代表。BRH 在适用的情况下保持对制造商设备注册和 BGMP 认证的控制。BRH 还参与与分销商协调每批货物的进口授权。
根据RDC 27/2011法规,电子电器类医疗产品必须先取得INMETRO证书。 证书有效期为5年。
四、审核流程
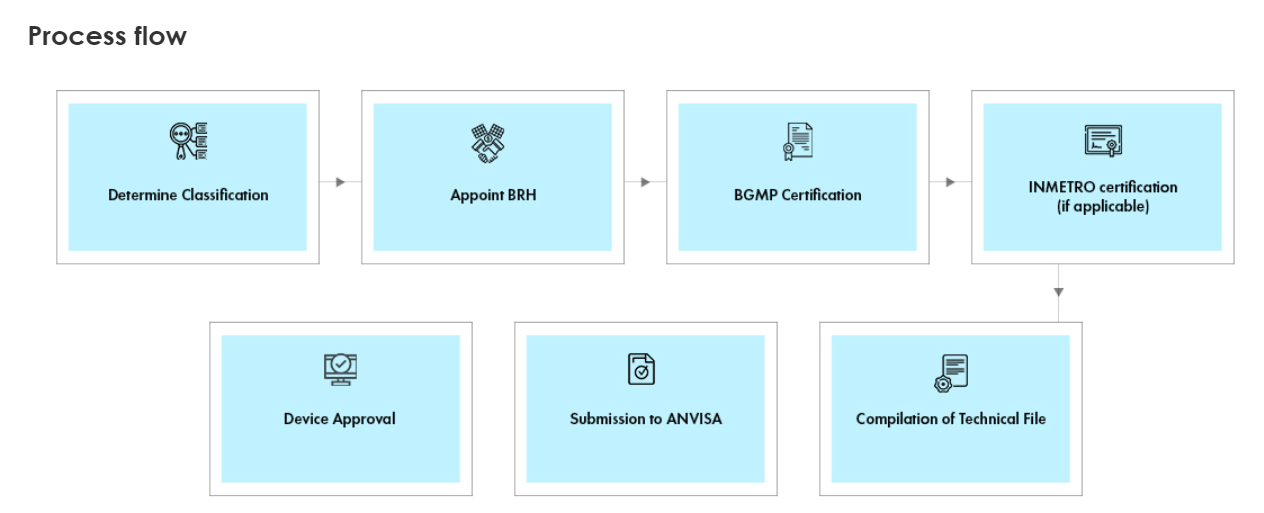
l 监管尽职调查服务
l 官方分类服务
l BGMP认证指导
l MDSAP认证指导
l Inmetro认证指导
l ANATEL认证指导
l 通过 Notificação 和 Registro 途径进行设备注册指导
l 推介巴西注册持有人 (BRH) 服务推荐
l 翻译服务
l 标签服务
l 经销商识别和资格服务推荐
l 批准后变更管理
l 许可证更新和转让服务